Wywiad z Panią Iwoną Lipką – diagnostką laboratoryjną z Zakładu Immunologii Klinicznej Uniwersyteckiego Szpitala Dziecięcego w Krakowie.
Diagnostyka schorzeń o podłożu autoimmunizacyjnym stanowi duże wyzwanie dla medycyny. Postawienie adekwatnej diagnozy często zajmuje wiele lat. Z czego wynikają te trudności? Jaką rolę w diagnostyce schorzeń o podłożu autoimmunizacyjnym odgrywa dialog pomiędzy diagnostą laboratoryjnym a lekarzem?
Immunologia jest jedną z najszybciej rozwijających się dziedzin medycyny. Wystarczy spojrzeć na ostatnią dekadę, by przekonać się, jak wiele nowych odkryć dokonano zarówno na polu diagnostycznym, jak i w zakresie terapii. Sprawa ma się podobnie w przypadku schorzeń o podłożu autoimmunizacyjnym.
Znamy coraz więcej autoprzeciwciał, do dyspozycji mamy wiele metod diagnostycznych, a mimo to ciągle istnieją problemy z szybkim postawieniem adekwatnej diagnozy. Trudności te wynikają między innymi z towarzyszących chorobom autoimmunizacyjnym niejednoznacznych objawów. Należą do nich: przewlekłe zmęczenie i osłabienie, stany podgorączkowe lub gorączki, podwyższone parametry zapalne, obrzęki i bóle stawów, bóle brzucha, przewlekłe biegunki, osłabienie i bóle mięśni oraz zmiany skórne. Objawy te często towarzyszą chorobom niemającym podłoża autoimmunizacyjnego.
Sprawy nie ułatwia także niejasna etiologia chorób autoimmunizacyjnych, bo któż z nas nie był kiedyś przeziębiony, nie zażywał leków czy nie uległ stresowi. W poznaniu przyczyny zaistniałych objawów kluczową rolę odgrywa wywiad lekarski, w którym zbiera się dane między innymi o predyspozycjach genetycznych pacjenta. Pozyskane przez lekarza informacje są pomocne w procesie diagnostycznym i mogą wpłynąć na skrócenie czasu ustalania ostatecznego rozpoznania, pod warunkiem iż lekarz podzieli się tą wiedzą z diagnostą laboratoryjnym i weźmie pod uwagę jego sugestie. Lekarz ma przed sobą pacjenta z konkretnymi objawami, zna historię jego dolegliwości, a diagnosta laboratoryjny posiada liczne narzędzia diagnostyczne (różnego rodzaju testy), dzięki którym może potwierdzić lub wykluczyć istnienie danej choroby.
Oznaczenie autoprzeciwciał jest najważniejsze w diagnostyce schorzeń o podłożu autoimmunizacyjnym. Immunologia to wciąż bardzo dynamicznie rozwijająca się dziedzina medycyny. Każdego roku identyfikuje się wiele nowych autoprzeciwciał, które są wykorzystywane w diagnostyce rutynowej. Czy na przestrzeni lat obserwuje Pani zwiększone zainteresowanie autoprzeciwciałami i tym samym wzrost liczby zlecanych badań?
Szybkie tempo rozwoju obserwowane w różnych dziedzinach życia dotyczy również diagnostyki laboratoryjnej. Co roku przybywają nam nowe autoprzeciwciała, ułatwiające i przyspieszające postawienie ostatecznej diagnozy przez reumatologa, immunologa, gastroenterologa czy endokrynologa. Obecnie lekarze nie wyobrażają sobie pracy bez wsparcia diagnostycznego ze strony laboratorium. Oczywiście na początku zlecanie badań nowych autoprzeciwciał idzie dość opornie, jednakże kilka pozytywnych wyników, współgrających z objawami klinicznymi, jest w stanie przekonać niejednego wątpiącego.
Nowo odkryte autoprzeciwciała stanowią często uzupełnienie znanych nam do tej pory. Przykładem może być diagnostyka cukrzycy typu 1 i przeciwciała przeciwko transporterowi cynku 8 (ZnT8), odkryte jako ostatnie. U większości pacjentów chorych na ten typ cukrzycy występują kombinacje różnych autoprzeciwciał, np. ICA (przeciwciała przeciwko wyspom trzustkowym), GADA (przeciwciała przeciwko dekarboksylazie kwasu glutaminowego), IA-2A (przeciwciała przeciwko fosfatazie tyrozynowej), IAA (przeciwciała przeciwko insulinie), ale u 3–5% pacjentów pojawiają się wyłącznie przeciwciała przeciwko transporterowi cynku 8 (ZnT8). Ponadto właśnie ten rodzaj autoprzeciwciał występuje u 56–72% dzieci z rozpoznaniem cukrzycy typu 1 i może być wykryty na wiele lat przed pełnoobjawową manifestacją choroby. Co więcej, mali pacjenci posiadający te przeciwciała są bardziej narażeni na rozwinięcie się cukrzycy insulinozależnej typu 1.
Dużą popularność zyskały również autoprzeciwciała występujące w neurologicznych zespołach paranowotworowych (NZP). Niesamowite jest, iż obecność danych autoprzeciwciał możemy połączyć z określonym typem nowotworu. Objawy NZP wyprzedzają zwykle o kilka miesięcy rozpoznanie pierwotnego nowotworu i umożliwiają podjęcie odpowiedniego leczenia we wczesnej fazie jego rozwoju.
Znacznym zainteresowaniem cieszy się także oznaczenie poziomu leków biologicznych (m.in. infliksymabu czy adalimumabu), stosowanych w leczeniu chorób autoimmunizacyjnych. W naszym szpitalu gastroenterolodzy w leczeniu choroby Leśniowskiego-Crohna, poza lekami działającymi na układ odpornościowy (steroidy, analogi puryn, metotreksat), stosują także infliksymab. Oznaczenie poziomu tego leku w surowicy leczonych pacjentów jest dla lekarzy niezbędne w celu ustalenia dawki odpowiedniej dla najskuteczniejszej terapii.
Podsumowując, mając coraz szerszą ofertę diagnostyczną dla chorób o podłożu autoimmunizacyjnym, cieszymy się wzrostem zainteresowania ze strony lekarzy, a co za tym idzie – zwiększoną liczbą zleceń na poszczególne badania.
Czy może Pani podzielić się z nami ciekawymi przypadkami diagnostycznymi, w których bardzo dużą rolę odegrało oznaczenie autoprzeciwciał i kooperacja pomiędzy diagnostą a lekarzem?
Przypadek 1
Lipiec 2023, książkowy toczeń układowy (SLE).
Dziewczynka 12-letnia przyjęta na Oddział Reumatologii z powodu podejrzenia tocznia.
W wywiadzie w kwietniu 2023 r. u pacjentki wystąpił obustronny obrzęk stawów skokowych. Wówczas w badaniach potwierdzono boreliozę i zastosowano amoksycylinę.
W czerwcu, po powrocie znad morza, u dziewczynki zaobserwowano na twarzy zmiany rumieniowe w kształcie motyla. Po kilku dniach zmiany rumieniowe pojawiły się również na skórze kończyn górnych, towarzyszyły im bóle drobnych stawów rąk. Zaobserwowano też zasinienia na łokciach i bladość stóp.
W wywiadzie rodzinnym u mamy zespół Sjögrena leczony arechinem.
W badaniach laboratoryjnych wysokie OB: 79 mm/min, CRP ujemne.
W badaniu ogólnym moczu leukocyturia i erytrocyturia, niewielki białkomocz.
Badanie bakteriologiczne moczu – mocz jałowy.
W morfologii niewielka limfocytoza i monocytoza, parametry biochemiczne bez odchyleń.
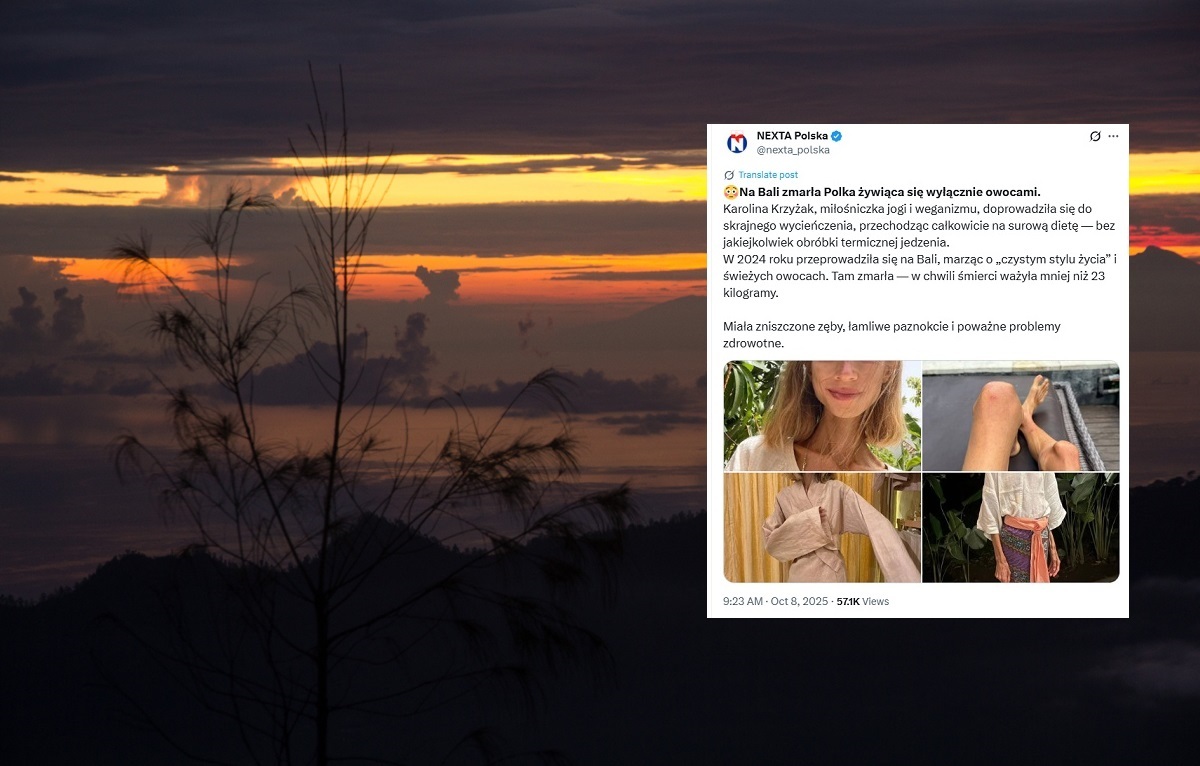
W badaniach immunologicznych podwyższony poziom immunoglobulin IgG i IgA, niskie składowe dopełniacza C3c i C4, przeciwciała antyfosfolipidowe (przeciw beta-2-glikoproteinie i kardiolipinie) ujemne, dodatnie przeciwciała przeciwjądrowe o dwojakim, homogennym i ziarnistym z pozytywnymi płaszczyznami chromosomów, typie świecenia w wysokim mianie (fot. 1a, 1b i 1c), w blocie wynik dodatni dla autoprzeciwciał anty-dsDNA i anty-Ku oraz słabo dodatnie anty-DFS70, autoprzeciwciała anty-dsDNA-NcX metodą ELISA dodatnie (649 IU/ml, wartości referencyjne <100 ujemne, >100 dodatnie).
Obecne przeciwciała anty-SARS w klasie IgG i EBV w klasie IgG.
Na podstawie obrazu klinicznego oraz wyników badań według wytycznych EULAR/ACR 2019 rozpoznano toczeń rumieniowaty. Aktywność choroby w skali SLEDAI oceniono na 10 punktów. Do leczenia włączono arechin i rozpoczęto sterydoterapię. Podczas pobytu obserwowano stopniowe ustępowanie zmian skórnych i białka w moczu.
Przypadek 2
Maj 2023, colitis ulcerosa (wrzodziejące zapalenie jelita grubego).
Dziewczynka 16-letnia została przyjęta na Oddziału Gastroenterologii możliwie jak najszybciej z SOR z powodu krwawienia z dolnego odcinka przewodu pokarmowego. Dwa miesiące wcześniej przebyła COVID-19, otrzymała antybiotyk. Po terapii antybiotykiem zaczęła oddawać stolce z krwią. Przy przyjęciu zgłaszała nudności i bóle brzucha w podbrzuszu, zawroty głowy, uderzenia gorąca bez gorączki, osłabienie. Od lutego 2023 schudła 9 kg. W rejonie wykonano oznaczenie kalprotektyny – 1180 ug/g.
W wywiadzie PCOS (zespół policystycznych jajników), insulinooporność, na stałe przyjmuje metforminę. Podejrzenie alergii na orzechy włoskie. Cukrzyca typu 2 u obu babć.
W podstawowych badaniach laboratoryjnych podwyższone OB, pozostałe wyniki w zakresach referencyjnych, wykluczono zakażenie bakteryjne i wirusowe przewodu pokarmowego.
Wykonano USG jelit , gastro- i kolonoskopię z pobraniem wycinków oraz MRI jelit.
W badaniach immunologicznych ASCA w klasie IgA i IgG ujemne, dodatnie autoprzeciwciała anti-goblet cells (fot. 2a i 2b) i pANCA (fot. 3) metodą IIFT, w profilu ANCA słabo dodatnie autoprzeciwciała anty-laktoferyna (indeks 1,7, wartości referencyjne >1, a <2 słabo dodatnie).
Na podstawie całokształtu obserwacji klinicznej i wykonanych badań rozpoznano chorobę colitis ulcerosa, włączono pentasę doustnie i we wlewkach, rozpoczęto indukcję remisji opartą na wyłącznym żywieniu dojelitowym, realizowanym drogą doustną, z dobrą tolerancją. Zaplanowano włączenie imuranu. Uzyskano poprawę konsystencji stolców i ustąpienie krwawienia.
W lipcu tego roku w kontrolnym USG jamy brzusznej nie uwidoczniono aktywnych zmian zapalnych w jelitach.

Przypadek 3
Autoimmunizacyjny zespół niedoczynności wielogruczołowej (APS): autoimmunizacyjna choroba tarczycy.
Niewydolność kory nadnerczy i jajników.
Kwiecień 2023
Pacjentka 14-letnia zgłosiła się na SOR z powodu uczucia duszności, trudności w oddychaniu, bólu w klatce piersiowej w okolicy przedmostkowej – ucisk i pieczenie, odczuwa wysiłek przy wchodzeniu po schodach, także przy chodzeniu po płaskich powierzchniach. Ból w klatce występuje przez cały dzień, promieniuje okresowo do nadbrzusza. Od 5 dni biegunka. Prawdopodobna przyczyna – stres z powodu egzaminów 8-klasisty.
W wywiadzie u mamy hiperprolaktynemia, babcia – RZS, w rodzinie taty – SM.
Choroby przewlekłe – niedoczynność tarczycy zdiagnozowana w styczniu 2023.
Wykonano RKZ – gazometrycznie wyrównana, jonowo sód 131 mmol/l, poza tym bez odchyleń.
W EKG i RTG klatki piersiowej bez nieprawidłowości, test troponinowy ujemny.
Zlecono dalsze leczenie w trybie ambulatoryjnym.
Maj 2023
W maju dwukrotnie hospitalizowana w innym szpitalu z powodu biegunki i bólu brzucha z osłabieniem i męczliwością, gdzie stwierdzono wysoki poziom kalprotektyny (955 ug/g), hiponatremię (121 mmol/l), hipochloremię i hiperkaliemię.
Empirycznie wdrożono leczenie azytromycyną i kotrimoksazolem z częściową poprawą. Konsultowana kardiologicznie – nie stwierdzono kardiologicznych przyczyn powyższych dolegliwości.
Wykonano gastro- i kolonoskopię, rozpoznano zapalenie żołądka o etiologii H. pylori, zastosowano metronidazol i amoksycylinę.
Czerwiec 2023
Dziewczynka przyjęta na SOR z powodu zawrotów głowy i duszności, w stanie ogólnym umiarkowanie dobrym, wydolna oddechowo (duszność głównie w pozycji siedzącej) i krążeniowo, w prawidłowym kontakcie, odwodniona w stopniu lekkim, osłabiona, tachykardia, chód chwiejny. Skóra ziemista, przebarwiona wokół ust, pod oczami i na dłoniach.
W RKZ hiponatremia, w EKG tachykardia zatokowa.
Pacjentkę przyjęto na Oddział Endokrynologii.
W badaniach laboratoryjnych stwierdzono przez cały czas utrzymujący się niski poziom sodu – 127 mmol/l, potas – 5,95 mmol/l, nieznacznie podwyższony poziom cukru – 6,3 mmol/l. Zlecono podaż 3% NaCl.
W morfologii cechy hemokoncentracji, parametry zapalne niskie.
Pozostałe badania: mocznik, kreatynina, albumina – w normie.
Diureza sprawna, mocz jasny, bez objawów dyzurycznych.
Stężenia jonów (sód, wapń, magnez, fosfor) w dobowej zbiórce moczu prawidłowe.
Stężenie TSH niskie, przy nieco podwyższonym stężeniu FT3 – zadecydowano o zmniejszeniu dawki euthyroxu.
Stężenie kortyzolu niskie. W teście stymulacji syntetycznym ACTH wykazano brak wzrostu kortyzolu.
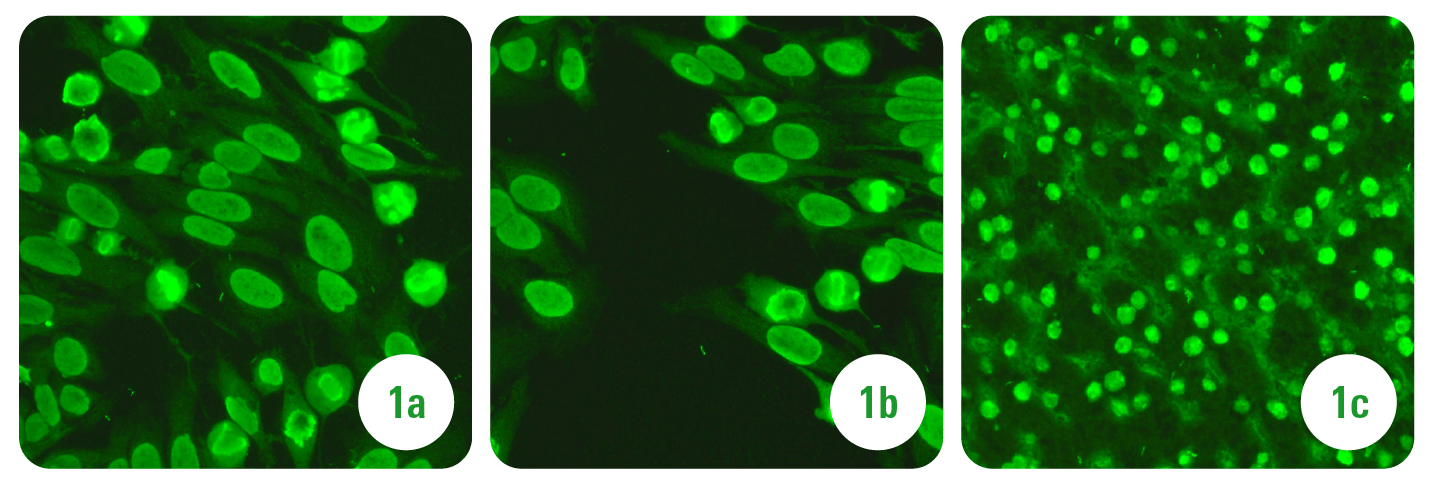
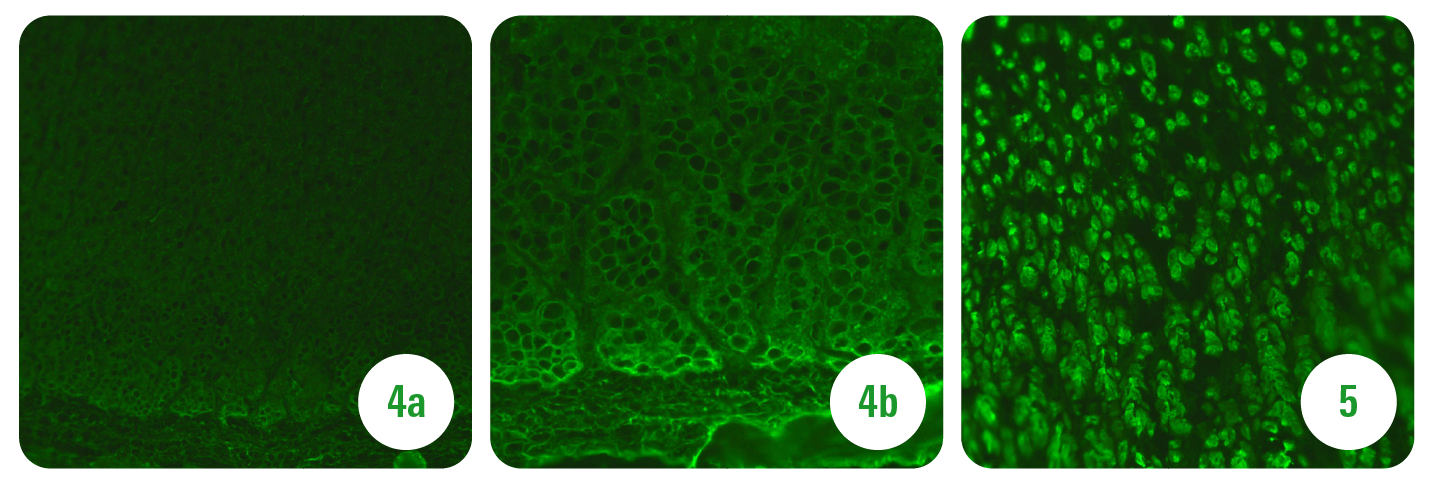
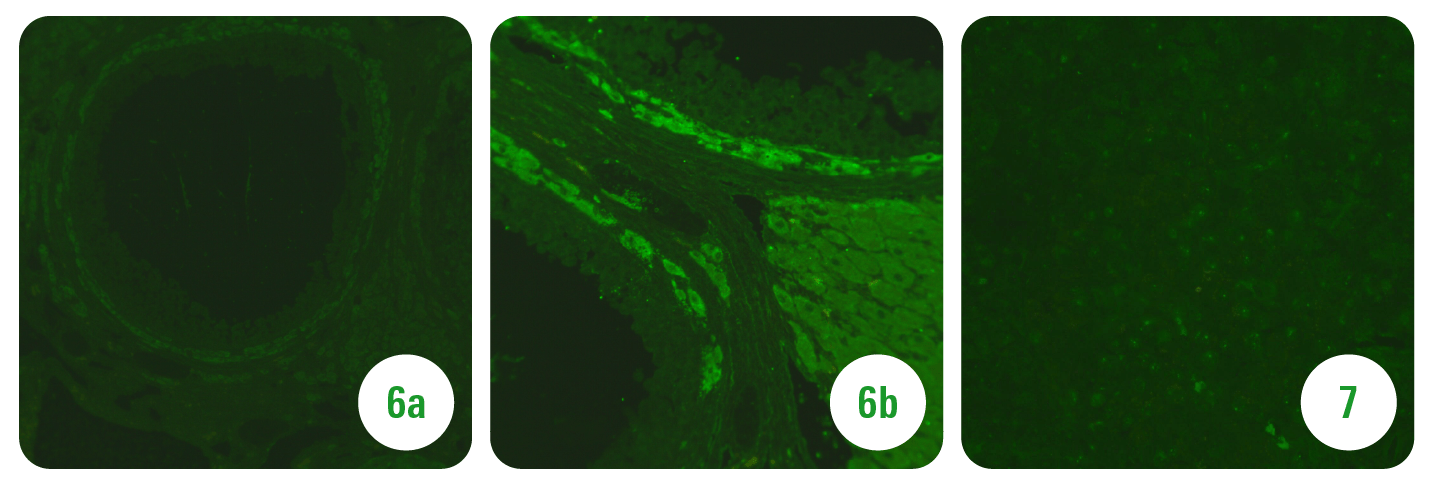
W badaniach immunologicznych obecne autoprzeciwciała nadnerczowe (fot. 4a i 4b), przeciw komórkom okładzinowym żołądka (fot. 5) i jajnika – przeciw komórkom tekalnym (fot. 6a i 6b). Wykluczono cukrzycę typu 1 (brak obecności autoprzeciwciał przeciw komórkom β wysp Langerhansa (fot. 7), anty-GAD, anty-IA2 i anty-ZnT8) i celiakię (brak obecności autoprzeciwciał przeciw endomysium i transglutaminazie tkankowej).
Rozpoczęto wyrównywanie natremii i.v., włączono hydrokortyzon i fludrokortyzon.
Została wypisana do domu w stanie ogólnym dobrym, bez dolegliwości.
Zalecono dalsze kontrole w poradniach: endokrynologicznej, ginekologicznej i gastroenterologicznej.
Jak Pani zdaniem powinna wyglądać kooperacja pomiędzy lekarzem a diagnostą laboratoryjnym, aby proces stawiania diagnozy w przypadku schorzeń o podłożu autoimmunizacyjnym był jak najkrótszy?
W celu skrócenia czasu upływającego od momentu pojawienia się pacjenta w gabinecie lekarskim do postawienia ostatecznej diagnozy konieczna jest kooperacja lekarza i diagnosty. Powinna ona opierać się na dialogu, obustronnym zrozumieniu i szacunku.
Wskazane jest, by na skierowaniu na badanie lekarz umieścił rozpoznanie lub przynajmniej podejrzenie choroby. Osobiście jestem zwolenniczką kontaktów telefonicznych, gdy każda ze stron może bezpośrednio podzielić się swoimi przypuszczeniami czy hipotezami, dopytać o szczegóły dotyczące objawów, wywiadu rodzinnego albo wyników badań biochemicznych, wirusologicznych lub patomorfologicznych. Wtedy diagnosta może służyć lekarzowi swoją wiedzą i doświadczeniem w doborze najodpowiedniejszych testów. Może też podpowiedzieć, o jakie badania warto rozszerzyć diagnostykę w konkretnym przypadku, by potwierdzić lub wykluczyć stawianą hipotezę.
Wszyscy diagności podlegają obowiązkowi ustawicznego kształcenia się, dlatego mamy wiedzę na temat ciekawostek i nowinek diagnostycznych, którą chętnie dzielimy się z lekarzami.
Dziękuję za rozmowę.
Rozmawiała: Małgorzata Kozłowska

Małgorzata Kozłowska
Kierownik Działu Informacji Naukowej, Product Manager ds. ANA, ANCA
514 892 443