
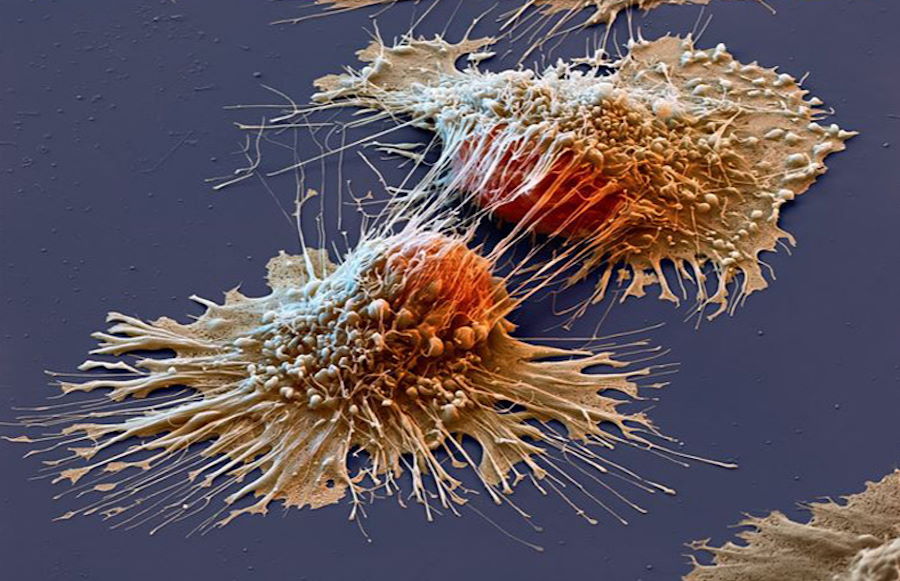
Naukowcy znaleźli sposób na zagłodzenie komórek nowotworowych dzięki komórek brunatnej tkanki tłuszczowej. Te żarłoczne komórki gwałtownie zużywają składniki odżywcze, pozbawiając komórki nowotworowe paliwa, którego potrzebują do rozwoju i przeżycia. dzięki tej metody badacze pokonali pięć różnych typów raka w eksperymentach laboratoryjnych.
Naukowcy zainspirowani metodami wykorzystywanymi w liposukcji i chirurgii plastycznej opracowali technikę, która może pozbawić komórki nowotworowe składników odżywczych. Najpierw przekształcili zwykłe komórki tłuszczowe w komórki brunatnej tkanki tłuszczowej, które agresywnie spalają kalorie, aby wytworzyć ciepło. Następnie wszczepili zmodyfikowane komórki w pobliże guzów rozwijających się w mysich modelach, podobnie jak chirurdzy plastyczni przenoszą tłuszcz z jednej części ciała do drugiej w celu poprawy wyglądu. W wyniku tego zabiegu zmodyfikowane komórki gwałtownie zużyły dostępne składniki odżywcze, nie zostawiając nic komórkom nowotworowym.
Wyniki oraz opis badań ukazała się na łamach pisma „Nature Biotechnology” (DOI: 10.1038/s41587-024-02551-2).
Brązowy tłuszcz kontra nowotwory
Brunatna tkanka tłuszczowa, znana również jako brązowy czy beżowy tłuszcz, jest jednym z dwóch głównych rodzajów tłuszczu występującego u ludzi i innych ssaków. Kolor tej tkanki wynika z dużej liczby mitochondriów. Początkowo uważano, iż brunatne adipocyty, czyli komórki budujące tkankę tłuszczową, występują wyłącznie u niemowląt i hibernujących ssaków, ale w ostatnich latach odkryto, iż dorośli także mają brązowy tłuszcz. Jego główną funkcją jest wytwarzanie ciepła poprzez spalanie kalorii w przeciwieństwie do białego tłuszczu (zwanego także żółtym), którego główną funkcją jest magazynowanie energii.
Naukowcy z University of California w San Francisco (UCSF) wykorzystali komórki brunatnej tkanki tłuszczowej, by pozbawić komórki nowotworowe składników odżywczych. dzięki narzędzia do edycji genów CRISPR-Cas9 przekształcili komórki białej tkanki tłuszczowej w komórki brunatnej tkanki tłuszczowej, które są znane ze swojej umiejętności spalania kalorii w celu generowania ciepła. Następnie wystawili je na kontakt z mysimi modelami kilku nowotworów. Zmodyfikowane komórki tłuszczowe gwałtownie wchłonęły najważniejsze składniki odżywcze, skutecznie pozbawiając komórki nowotworowe paliwa. Co ciekawe, podejście to działało choćby wtedy, gdy zmodyfikowane komórki tłuszczowe umieszczono stosunkowo daleko od guza.
Istotne w tych badaniach jest to, iż opracowana metoda opiera się na istniejących procedurach medycznych, co może doprowadzić do szybszego przejścia od badań klinicznych do stosowania jej u pacjentów cierpiących na chorobę nowotworową. – Rutynowo usuwamy komórki tłuszczowe dzięki liposukcji i przywracamy je dzięki chirurgii plastycznej – powiedział Nadav Ahituv z UCSF, współautor publikacji. – Tymi komórkami tłuszczowymi można łatwo manipulować w laboratorium i bezpiecznie umieszczać je z powrotem w organizmie, co czyni je atrakcyjną platformą do terapii komórkowej, w tym w leczeniu raka – dodał.
Wiecznie głodne komórki tłuszczowe
Autorzy publikacji wcześniej zwrócili uwagę na badania, które wykazały, iż ekspozycja na zimno może hamować rozwój raka u myszy. Wiedzieli też, iż zimno aktywuje brunatne komórki tłuszczowe, które wykorzystują składniki odżywcze do wytwarzania ciepła i ogrzania organizmu. Uznali, iż zahamowanie rozwoju nowotworu u myszy po ekspozycji na zimno może wynikać z tego, iż komórki nowotworowe głodują, bo brunatna tkanka tłuszczowa zużyła wszystkie dostępne zasoby, by nieco ogrzać myszy.
Ale ekspozycja pacjentów onkologicznych na zimno może nie być najlepszą opcją, dlatego uczeni zaczęli opracowywać strategie wykorzystanie brunatnego tłuszczu. Założyli, iż mogą go zaprojektować tak, by zużywał wszystkie dostępne składniki odżywcze bez potrzeby aktywowania go zimnem.
Wykorzystali technikę CRISPR-Cas9 do aktywacji genów, które są uśpione w białych komórkach tłuszczowych, ale są aktywne w brunatnych komórkach tłuszczowych, w nadziei na znalezienie tych, które przekształcą białe komórki tłuszczowe w wiecznie głodne brunatne komórki tłuszczowe. W ten sposób znaleźli gen o nazwie UCP1.
W dalszych badaniach hodowali przekształcone z białych komórek tłuszczowych brunatne komórki tłuszczowe razem z komórkami nowotworowymi. Komórki tłuszczowe i nowotworowe znajdowały się w oddzielnych przestrzeniach, ale miały dostęp do wspólnej części, w której badacze umieścili składniki odżywcze. Okazało się, iż komórki nowotworowe nie mają najmniejszych szans w wyścigu o pokarm z brązowym tłuszczem.
– W naszym pierwszym eksperymencie kilka komórek rakowych przeżyło. Uznaliśmy, iż coś popsuliśmy. Byliśmy pewni, iż to pomyłka. Więc powtórzyliśmy eksperyment i to wiele razy. Za każdym razem obserwowaliśmy ten sam efekt – przyznał Ahituv.
Obiecujące wyniki testów
W eksperymentach na szalkach Petriego komórki brunatnej tkanki tłuszczowej skutecznie pozbawiały składników odżywczych dwa różne typy komórek raka piersi, a także komórki raka jelita grubego, trzustki i prostaty. Ale przez cały czas nie było wiadomo, jak brązowy tłuszcz poradzi sobie w bardziej realistycznych warunkach.
W kolejnym kroku badacze skorzystali ze skupisk komórek tłuszczowych hodowanych w laboratorium, aby sprawdzić, czy mogą pokonać komórki nowotworowe, gdy zostaną wszczepione obok guzów u myszy. W tym przypadku głodne komórki brązowego tłuszczu także wygrały wyścig o składniki odżywcze. Podejście to skutecznie zahamowało rozwój komórek raka piersi, trzustki i prostaty.
Wszczepione komórki beżowego tłuszczu były tak dobre, iż hamowały rozwój guzów trzustki i piersi u myszy, które były genetycznie predysponowane do rozwoju nowotworów piersi. Co więcej, komórki brunatnej tkanki tłuszczowej szybciej zużywały składniki odżywcze nawet, gdy zostały wszczepione stosunkowo daleko od komórek raka piersi.
Naukowcy przetestowali brązowy tłuszcz także na tkance ludzkiej. Jennifer Rosenbluth, również z UCSF, dostarczyła próbki mastektomii zawierające zarówno komórki tłuszczowe, jak i nowotworowe. Naukowcy przekształcili komórki tłuszczowe z próbki pobranej od jednej pacjentki i przetestowali je komórkach raka piersi tej samej osoby. W testach na szalce Petriego brązowy tłuszcz zagłodził komórki nowotworowe. Podobnie stało się, gdy badacze wszczepili oba rodzaje komórek razem do organizmu myszy.
Projektowanie komórek tłuszczowych
Różne nowotwory preferują różne składniki odżywcze. Na przykład taki rak trzustki, gdy brakuje glukozy, zabiera się z urydynę. Naukowcy zmodyfikowali tłuszcz tak, aby spożywał tylko określone składniki odżywcze, w tym przypadku tylko urydynę. Tak przygotowane komórki brązowego tłuszczu z łatwością wygrały wyścig o pokarm. To sugeruje, iż tłuszcz można dostosować do preferencji dietetycznych nowotworów.
Komórki tłuszczowe można łatwo uzyskać od pacjentów. Dobrze rosną w laboratorium i można je zmodyfikować tak, aby wyrażały różne geny i przyjmowały różne role biologiczne. Co więcej, nie sprawiają problemów, gdy zostaną ponownie wprowadzone do organizmu, nie oddalając się od miejsca, w którym zostały wszczepione i dobrze współpracując z układem odpornościowym.
Badacze sądzą, iż komórki tłuszczowe można również zaprogramować tak, aby emitowały sygnały lub wykonywały bardziej skomplikowane zadania. – Uważamy, iż te komórki można również zaprojektować tak, aby wykrywały glukozę we krwi i uwalniały insulinę w przypadku cukrzycy lub wchłaniały żelazo w chorobach, w których występuje nadmiar żelaza, takich jak hemochromatoza – przyznał Ahituv.
Źródło: University of California w San Francisco, fot. Sam Levin/ Flickr. CC BY 2.0









![[PILNE] Wydarzył się cud świętego Januarego. Krew męczennika zmieniła stan skupienia](https://static.deon.pl/storage/image/core_files/2025/12/16/37ba338070c2ec35beda1890184c1a7f/webp/deon/feed/pilne-cud-sw-januarego-jednak-sie-wydarzyl-o-1739-krew-zmienila-stan-skupienia.webp)


.webp)

.webp)


