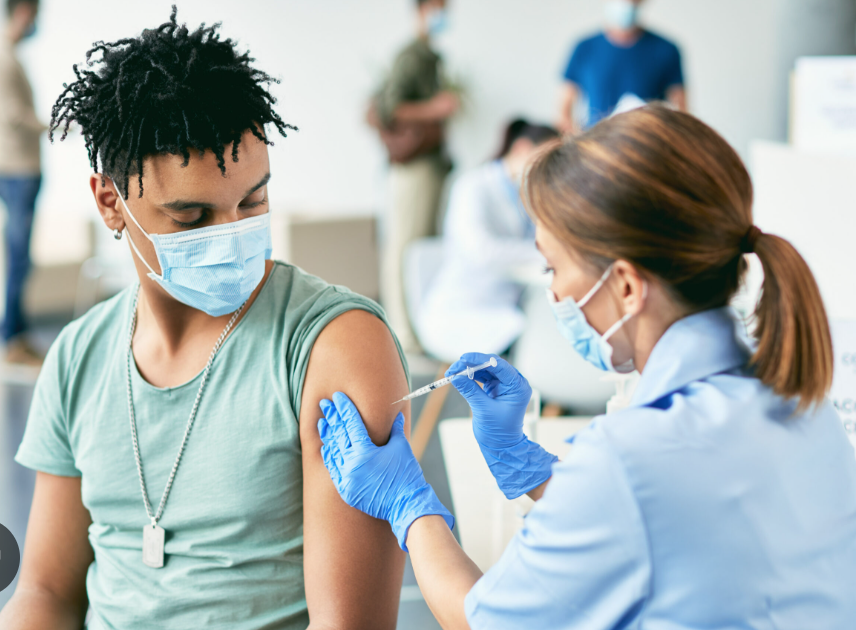
RSV jest powszechnym wirusem układu oddechowego, który zwykle powoduje łagodne, podobne do przeziębienia objawy, ale może powodować poważne konsekwencje dla dzieci i osób starszych. U dzieci RSV jest główną przyczyną hospitalizacji pediatrycznej w Europie. Może powodować zapalenie oskrzelików i zapalenie płuc, może też prowadzić do śmiertelnej niewydolności oddechowej.
Zakażenie RSV może być również poważne dla dorosłych w wieku 50 lat i starszych, ponieważ może powodować ostre zakażenie dróg oddechowych, chorobę grypopodobną lub pozaszpitalne zapalenie płuc.
Preparat składa się z dwóch rekombinowanych glikoprotein powierzchniowych RSV wybranych w celu optymalizacji ochrony przed szczepami RSV A i B. Białka te są niezbędne do zakażenia organizmu przez RSV, a także są głównymi celami przeciwciał generowanych do walki z infekcją.
Rekomendację przyznano w ramach mechanizmu przyspieszonej oceny EMA, ponieważ zapobieganie chorobie RSV jest uważane za ważne dla zdrowia publicznego.
Kiedy dana osoba otrzymuje szczepionkę, jej układ odpornościowy wytwarza specyficzne przeciwciała i limfocyty T (komórki układu odpornościowego), które pomagają zapobiegać zakażeniu RSV. W przypadku kobiet w ciąży przeciwciała neutralizujące przenikają przez łożysko, zapewniając niemowlętom ochronę do 6 miesięcy po urodzeniu.
Opinia Komitetu ds. Leków Stosowanych u Ludzi (CHMP) EMA opiera się na danych z dwóch randomizowanych, kontrolowanych placebo kluczowych badań.
W jednym z badań 3695 osobom w 24.–36. tygodniu ciąży podano szczepionkę, a 3697 otrzymało placebo (wstrzyknięcie pozorowane). Ocena wykazała, iż szczepionka była skuteczna w zmniejszaniu zarówno ciężkiej choroby dolnych dróg oddechowych, jak i medycznie związanej z chorobą dolnych dróg oddechowych występującą w ciągu 180 dni po urodzeniu.
W drugim badaniu szczepionkę podano 18 488 dorosłym w wieku 60 lat i starszym, a 18 479 otrzymało placebo. Wyniki badania wykazały skuteczność leku w zmniejszaniu choroby dolnych dróg oddechowych związanej z RSV z 2 (lub więcej) objawami i 3 (lub więcej) objawami.
Najczęstsze działania niepożądane zgłaszane u osób między 24. a 36. tygodniem ciąży to ból w miejscu szczepienia, ból głowy i ból mięśni. U osób w wieku 60 lat i starszych najczęściej zgłaszanym działaniem niepożądanym był ból w miejscu szczepienia.
Opinia EMA zostanie teraz przesłana Komisji Europejskiej w celu przyjęcia decyzji w sprawie pozwolenia na dopuszczenie do obrotu w całej UE. Po przyznaniu pozwolenia na dopuszczenie do obrotu decyzje dotyczące ceny i refundacji będą podejmowane na szczeblu każdego państwa członkowskiego, z uwzględnieniem potencjalnej roli/zastosowania tego leku w kontekście krajowego systemu opieki zdrowotnej tego kraju.