Analiza całego genomu pacjenta otwiera nowy rozdział w medycynie precyzyjnej, umożliwiając głębokie zrozumienie biologicznego podłoża wielu chorób, w tym nowotworowych. Dzięki niej lekarze mogą nie tylko szybciej i trafniej postawić diagnozę, szczególnie w przypadku rzadkich lub złożonych schorzeń genetycznych, ale też przewidywać ryzyko ich wystąpienia na długo przed pojawieniem się objawów.
Kluczową korzyścią jest również rozwój farmakogenomiki – dziedziny badającej, jak nasze geny wpływają na reakcję organizmu na leki. To pozwala dobierać terapie nie tylko skuteczniejsze, ale i bezpieczniejsze, minimalizując ryzyko działań niepożądanych.
Analiza całego genomu (WGS – Whole Genome Sequencing) to zaawansowana technologia badawcza, która umożliwia odczytanie i analizę pełnej sekwencji DNA organizmu. To najbardziej kompleksowe badanie genetyczne, które otwiera nowe możliwości profilaktyki i leczenia spersonalizowanego.
W dłuższej perspektywie analiza genomu może wspierać profilaktykę i personalizację leczenia na niespotykaną dotąd skalę, zmieniając sposób, w jaki rozumiemy i praktykujemy medycynę.
Analiza całego genomu – badanie WGS
Jak wyjaśnia dr hab. n. med. Paula Dobosz, wybitna genetyk i edukatorka specjalizująca się w obszarze genetyki i genomiki nowotworów – w ostatnich latach obserwujemy prawdziwą rewolucję w podejściu do leczenia i coraz częściej odchodzimy od „uniwersalnych” metod na rzecz medycyny spersonalizowanej.
Kluczem do tego przełomu jest analiza całego genomu pacjenta, czyli pełne odczytanie i interpretacja jego materiału genetycznego. Co warto wiedzieć na temat analizy całego genomu?
-
- Diagnostyka nowej generacji – Dzięki analizie genomu lekarze są w stanie dotrzeć do przyczyn chorób, które wcześniej pozostawały niewyjaśnione. To ogromna szansa dla osób cierpiących na rzadkie lub wieloczynnikowe schorzenia, które nie dają jednoznacznych objawów. Zamiast długich lat prób i błędów w poszukiwaniu diagnozy, możliwe jest szybkie wskazanie konkretnego zaburzenia genetycznego – a co za tym idzie, skuteczniejsze leczenie.
- Farmakogenomika – geny a leki – Nie każdy organizm reaguje na leki tak samo. Genomika pozwala zrozumieć, które warianty genetyczne wpływają na metabolizm konkretnych substancji – co oznacza, iż lekarz może dobrać nie tylko odpowiedni lek, ale i jego optymalną dawkę. Dzięki temu zmniejszamy ryzyko działań niepożądanych, zwiększamy skuteczność leczenia i unikamy kosztownych błędów terapeutycznych.
- Profilaktyka i medycyna predykcyjna – Jedną z najbardziej obiecujących korzyści analizy genomu jest możliwość przewidywania ryzyka chorób jeszcze zanim się pojawią. Osoby z predyspozycjami genetycznymi do nowotworów, chorób serca czy neurodegeneracyjnych mogą wcześniej podjąć działania profilaktyczne – od zmiany stylu życia po odpowiedni monitoring medyczny. To nie tylko ratunek dla zdrowia, ale i realna oszczędność dla systemów opieki zdrowotnej.
- Społeczne i systemowe korzyści – W szerszej perspektywie, dostęp do danych genomowych tysięcy pacjentów pozwala tworzyć bardziej precyzyjne wytyczne kliniczne i wspiera rozwój nowych terapii. Dobrze zarządzane programy genomowe stają się fundamentem nowoczesnych systemów opieki zdrowotnej – opartych na wiedzy, technologii i etycznym podejściu do pacjenta.
Analiza całego genomu to nie odległa przyszłość – to już dziś realne narzędzie, które zmienia jakość opieki zdrowotnej. Im szybciej wdrożymy je na szeroką skalę, tym więcej osób skorzysta z dobrodziejstw nowoczesnej, skutecznej i bezpiecznej medycyny – tłumaczy dr hab. n. med. Paula Dobosz.
DOWIEDZ SIĘ WIĘCEJ: ONKOLOGIA PRECYZYJNA
Analiza całego genomu w diagnostyce nowotworów
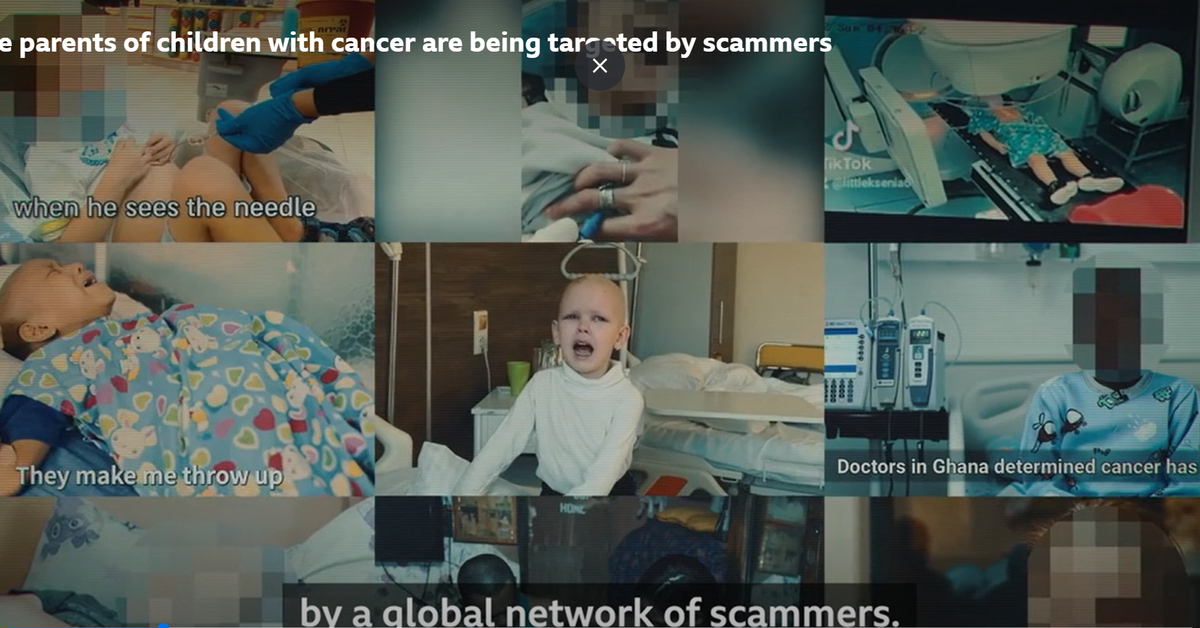
Geny decydują o większości naszych cech, zwłaszcza fizycznych, o wzroście, kolorze włosów czy oczu. Niestety, czasem warunkują one w naszym organizmie również rozwój choroby nowotworowej. Nowotwór należy postrzegać nie jako chorobę narządu, ale pojedynczych komórek, w genomach których doszło do patogennych zmian i w konsekwencji do niekontrolowanych podziałów komórek (rysunek 1).
Ponieważ mutacje mogą zajść niemalże w dowolnej komórce naszego organizmu, niezależnie od narządu, specjalistyczne testy genetyczne odgrywają ogromne znaczenie w diagnostyce i leczeniu nowotworów. Nowością na polu diagnostyki genetycznej nowotworów jest tzw. analiza całego genomu. To najnowocześniejsza technologia, z którą naukowcy wiążą wielkie nadzieje.
Rysunek 1. Chorobotwórcze zmiany genetyczne w jednej komórce mogą prowadzić do rozwoju guza nowotworowego, niezależnie od tkanki czy organu.
Powszechnie stosowane genetyczne testy diagnostyczne można porównać do tytułu wielotomowej powieści: choć nawiązuje on do treści książki, to nie reprezentuje w pełni ukrytej w tekście historii. Analogicznie, identyfikacja mutacji w kilku genach może potwierdzić obecność nowotworu, jednak często nie daje pełnej informacji o jego przyczynach i molekularnym mechanizmie rozwoju. W konsekwencji, utrudnia to dobór skutecznej terapii.
Onkolodzy coraz częściej sięgają po innowacyjne metody diagnostyki genomowej, które pozwalają na identyfikację wszystkich mutacji prowadzących do rozwoju choroby nowotworowej. Jedną z nich jest analiza całego genomu, która ma szansę zrewolucjonizować leczenie onkologicznego i wydłużyć życie pacjentów z zaawansowanym nowotworem.
Przed decyzją o wykonaniu badań genetycznych warto zapoznać się z zaletami oraz ograniczeniami dostępnych na rynku metod diagnostycznych.
Diagnostyka genetyczna nowotworów
Powszechnie stosowane genetyczne testy diagnostyczne mają sporo ograniczeń. Przez wiele lat analizowano jedynie mutacje w sekwencji genów, mimo, iż większość materiału genetycznego stanowią tzw. regiony międzygenowe. Wiele badań dowodzi, iż mają one istotny wpływ na regulację procesów molekularnych w komórkach.
Najprostsze testy genetyczne wykorzystują klasyczne sekwencjonowanie metodą Sangera, która umożliwia odczyt pojedynczych patogennych wariantów genetycznych (potocznie: mutacji chorobotwórczych) w konkretnych genacn. Ta metoda jest dobrym rozwiązaniem w przypadku pacjentów z obciążeniem genetycznym, np. gdy pośród bliskich krewnych występowała choroba nowotworowa.
Możliwe jest również wykonanie sekwencjonowania celowanego (ang. Targeted Sequencing), które skupia się na wybranych fragmentach genów. Dzięki temu analizowane są te regiony materiału genetycznego, w których występuje najwyższe prawdopodobieństwo wykrycia mutacji.

Rysunek 2. 1. Zakres badania całogenomowego (WGS) – wszystkie chromosomy, cała informacja genetyczna zawarta w komórkach 2. Zakres badania panelowego – kilkanaście/kilkadziesiąt fragmentów genów.
Tradycyjne testy panelowe
Najbardziej popularne na rynku są aktualnie testy “panelowe” służące do analizy kilku lub kilkudziesięciu wybranych genów, w których najczęściej dochodzi do mutacji w określonym typie nowotworu. Dobrym przykładem jest powszechnie wykorzystywany panel genowy do badania raka piersi, który obejmuje analizę sekwencji dwóch genów: BRCA1 i BRCA2.
Nazwa “panel genowy” może wprowadzać w błąd: często badanie obejmuje zaledwie jeden lub kilka fragmentów sekwencji, których mutacje wpływają na rozwój choroby, a więc analizowanych jest tylko kilka liter w sekwencji całego genu. Choć badania tego typu są atrakcyjne cenowo, pomijają one mutacje występujące w innych fragmentach genu oraz w sekwencjach DNA pomiędzy genami.
Analiza całego genomu w oparciu o sekwencjonowanie DNA
Najnowocześniejsza technologia diagnostyczna dostępna dla pacjentów onkologicznych to analiza całego genomu, czyli tzw. profilowanie całogenomowe. Sekwencjonowanie całego DNA (z wykorzystaniem WGS, ang. Whole Genome Sequencing), czyli kompletnej informacji genetycznej znajdującej się w komórkach nowotworu, umożliwia zbadanie aż 99,9% całego materiału genetycznego, a więc wszystkich genów oraz sekwencji międzygenowych.
Warto pamiętać, iż geny stanowią jedynie niewielki procent naszego DNA (około 1-2%). Bardzo długie sekwencje, które występują pomiędzy nimi, mogą mieć także istotny wpływ na rozwój choroby nowotworowej (rysunek 2).
Analiza całego genomu (profilowanie genomowe) to jedyna metoda wykorzystująca sekwencjonowanie, która dodatkowo pozwala na wykrycie dużych zmian strukturalnych w chromosomach. Ponieważ cała sekwencja genomu to około 3 200 000 000 par nukleotydów, analiza i interpretacja uzyskanych informacji wymaga dużo czasu, zaawansowanych narzędzi informatycznych oraz udziału specjalistów z zakresu analityki genomowej.
Choć na pozór kosztowna, analiza całego genomu z wykorzystaniem sekwencjonowania staje się z roku na rok coraz bardziej przystępna cenowo. Warto podkreślić, iż badanie całego genomu swoim zakresem obejmuje wszystkie pozostałe (tradycyjne) testy (tabela 1).
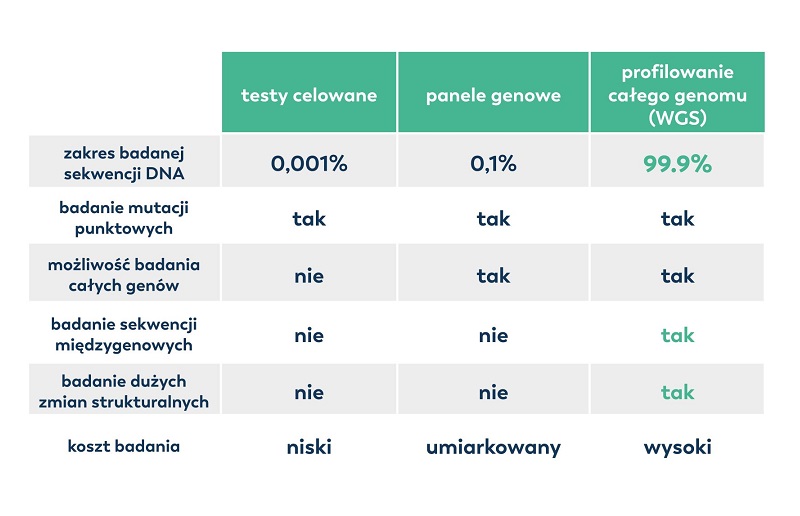
Tabela 1. Porównanie dostępnych metod diagnostyki genetycznej.
Analiza całego genomu – zastosowanie w onkologii
Nowotwór wywodzący się z tej samej tkanki nigdy nie jest tą samą chorobą – u różnych pacjentów może być wynikiem odmiennych mutacji DNA. I odwrotnie, nowotwory z dwóch różnych tkanek, u dwóch różnych pacjentów (na przykład nowotwór piersi u jednej pacjentki i nowotwór trzustki u innej) mogą być wywołane przez mutację w tym samym genie.
Profilowanie i analiza całego genomu umożliwiają wskazanie zmian genetycznych, które doprowadziły u danego pacjenta do onkogenezy oraz na dobranie indywidualnej terapii, która ma największe szanse powodzenia w danym przypadku.
Diagnostykę całogenomową i terapię celowaną zastosowano z powodzeniem u pacjentek z rakiem piersi. Poprzez identyfikację mutacji odkryto zmiany w funkcjonowaniu komórek, które stały się celem terapeutycznym. Dzięki temu, na rynek zostały wprowadzone leki i terapie celowane – ukierunkowane na receptor HER2 (ang. Human epidermal growth factor receptor 2).
Amerykańskie Towarzystwo Onkologiczne podaje, iż terapię celowaną ukierunkowaną na receptor HER2 można zastosować u około 15% pacjentek z rakiem piersi. Terapeutyki celowane mogą również pomóc pacjentkom, u których potwierdzono status receptorów hormonalnych ER (estrogen) i PR (progesteron) jako pozytywny. Oznacza to, iż na powierzchni komórek nowotworowych znajduje się duża liczba tych receptorów, a zatem pacjentki dobrze odpowiadają na leczenie hormonalne.
Niektóre terapie celowane jak np. inhibitory enzymów CDK4/6, mTOR czy PIK3 są w stanie zwiększyć skuteczność stosowanej terapii hormonalnej. Podobnych leków na rynku przybywa, a prace badawcze nad nowymi terapeutykami ukierunkowanymi na cele molekularne posuwają się do przodu.
Analiza całego genomu otwiera drzwi do skutecznej terapii również w raku jajnika. Jest to nowotwór niezwykle trudny do leczenia, ponieważ powstaje w wyniku różnorodnych zmian w DNA guza. Standardowe postępowanie obejmuje chirurgiczne usunięcie guza, a następnie chemioterapię opartą na związkach zawierających platynę. Choć początkowo taka terapia przynosi efekt, to w większości przypadków dochodzi do rozwoju oporności na terapię platyną, co prowadzi w konsekwencji do słabszej odpowiedzi na kolejne próby leczenia.
Alternatywnym rozwiązaniem jest zastosowanie terapii celowanej, indywidualnie dobranej dla danej pacjentki na podstawie konkretnych zmian w genomie komórek jej nowotworu.
Dobrym przykładem są stosowane w praktyce klinicznej inhibitory PARP. Do leczenia z ich użyciem kieruje się pacjentki na podstawie wyników sekwencjonowania genów BRCA1/BRCA2, jeżeli w tych genach zostaną zidentyfikowane warianty patogenne. Okazuje się, iż niektóre pacjentki pomimo braku mutacji w genach BRCA1/BRCA2 również mogą odnieść korzyść terapeutyczną z zastosowania inhibitorów PARP.
Wyzwaniem dla naukowców pozostaje rozpoznanie nowych zjawisk molekularnych, które określą grupę chorych mogących być beneficjentem takiego leczenia.

Rysunek 3. Przebieg terapii personalizowanej: na podstawie diagnostyki genetycznej grupę pacjentów z tym samym schorzeniem rozdziela się na różne typy molekularne choroby (kolory zielony, pomarańczowy i grafitowy). Dla każdej z tych grup dobierany jest lek o najlepszym możliwym działaniu terapeutycznym.
Analiza całego genomu – korzyści dla pacjentów
Poznanie zmian w genomie, które doprowadziły do rozwoju danego nowotworu, pozwala pacjentom i lekarzom bardziej świadomie walczyć z chorobą. Przede wszystkim umożliwia dobranie terapii, która ma największą szansę na powodzenie. W wielu przypadkach terapie celowane okazują się być mniej toksyczne i bardziej efektywne niż standardowe terapie przeciwnowotworowe (rysunek 3).
Na całym świecie realizowane są intensywne badania nad rozwojem nowych leków przeciwnowotworowych, prowadzone są setki badań klinicznych z ich wykorzystaniem.
Dodatkowo, analiza całego genomu może wskazać, czy pacjent jest oporny lub wrażliwy na zastosowanie konkretnego leczenia oraz czy wariant genetyczny, który spowodował powstanie guza, może zostać odziedziczony przez kolejne pokolenia. Jest to istotne dla potomstwa pacjenta, a ponadto oszczędza – cenny dla pacjentów – czas.
Bankowanie tkanki nowotworowej
Profilowanie nowotworów i analiza całego genomu wymagają, aby pobrana tkanka guza była odpowiednio przechowywana i nie uległa degradacji lub zanieczyszczeniu. Do wykonania rutynowych badań histopatologicznych wykorzystuje się komórki pobrane od pacjenta w trakcie resekcji guza lub biopsji. Jednak rutynowo stosowany sposób ich przechowywania uniemożliwia przeprowadzenie diagnostyki genomowej i histopatologicznej za jednym razem.
Innowacyjnym rozwiązaniem jest bankowanie tkanki nowotworowej. Podczas rutynowej procedury lekarz rozdziela pobraną tkankę guza na dwie części. Pierwsza przeznaczona jest do standardowych badań histopatologicznych, a druga – do bankowania i ewentualnej diagnostyki genomowej. Bankowana tkanka guza zostaje umieszczona w specjalnym buforze konserwującym, a następnie poddana kontroli jakości i zamrożona w -20°C.
Tak zabezpieczona tkanka może być przechowywana przez kilka lat. W tym czasie pacjent ma możliwość wykorzystania jej do różnego rodzaju genetycznych badań diagnostycznych, w tym analizy całego genomu.
Bankowanie tkanki nowotworowej daje pacjentowi możliwość skorzystania z badania jakim jest analiza całego genomu. W konsekwencji możliwe staje się poszukiwanie dla danego chorego terapii personalizowanej, zidentyfikowanie przyczyn oporności na daną terapię oraz ewentualne włączenie pacjenta do badań klinicznych nad nowymi lekami.
Rozwój medycyny i zaawansowanych technologii diagnostycznych postępuje szybciej niż kiedykolwiek wcześniej, a zrozumienie informacji zawartych w naszych genomach odgrywa coraz większą rolę. Analiza całego genomu jeszcze do niedawna wydawała się być diagnostyką przyszłości.
Okazuje się jednak, iż ta przyszłość… wcale nie jest tak odległa.
W artykule wykorzystano fragmenty publikacji, która powstała pierwotnie w 2020 roku we współpracy z firmą MNM Diagnostics.
Post Analiza całego genomu. Badanie WGS w diagnostyce nowotworów pojawił się poraz pierwszy w Zwrotnikraka.pl.