Operacje neurochirurgiczne są stałym i koniecznym elementem leczenia wielu schorzeń, w tym nowotworów ośrodkowego układu nerwowego. Wiążą się jednak z ryzykiem upośledzenia funkcji motorycznych i poznawczych w momencie, kiedy uszkodzeniu ulegną ważne struktury korowe (rejony elokwentne) lub szlaki nerwowe.
Tekst: Konrad Ciecierski, Mateusz Koryciński
Aby precyzyjnie je określić, każdy pacjent jest poddawany przed zabiegiem obrazowaniu z wykorzystaniem magnetycznego rezonansu jądrowego (ang. magnetic resonance imaging, MRI). Różne modalności tej techniki obrazowania pozwalają określić nie tylko anatomię mózgowia danego pacjenta, ale także mapować odpowiednie ośrodki elokwentne oraz drogi nerwowe łączące je z innymi partiami mózgu i ciała. Jest to konieczne, ponieważ plastyczność naszego układu nerwowego sprawia, iż dokładna lokalizacja poszczególnych struktur jest do pewnego stopnia osobnicza.
Obrazowanie magnetyczno-rezonansowe dostarcza ogromu danych, które należy przeanalizować, aby móc przystąpić do planowania operacji. Brzemię tego zadania spada na radiologów, którzy mogą wykorzystać dostępne narzędzia, aby usprawnić proces opisu badania. Rozwiązanie, które zostało opracowane w Zakładzie Zastosowań Sztucznej Inteligencji w Medycynie (AI-MED) w NASK-PIB pozwala na generowanie mapy połączeń strukturalnych na podstawie danych z Obrazowania Tensora Dyfuzji (ang. diffusion tensor imaging, DTI), jednej z modalności MRI. DTI pozwala na określenie kierunku ruchu cząsteczek wody w przestrzeni trójwymiarowej. Odzwierciedla to z kolei topologię aksonów – wydłużonych wypustek komórek nerwowych, które organizując się w pęczki, budują włókna nerwowe i łączą różne obszary mózgu ze sobą. Informacja o topologii tych połączeń daje neurochirurgowi możliwość zaplanowania operacji w taki sposób, aby ograniczyć ryzyko ich uszkodzenia w czasie zabiegu.
Opracowana metoda ma charakter hybrydowy i została nazwana HyTract. Wykorzystuje sztuczną sieć neuronową, która analizuje dane pochodzące bezpośrednio z badania rezonansem magnetycznym (DTI, rycina 1). Sieć neuronowa nie tworzy tutaj ostatecznej predykcji, a jedynie ważony graf możliwych połączeń. Połączenia te pozwalają na budowanie ścieżek odwzorowujących połączenia strukturalne istniejące w mózgu z wykorzystaniem zmodyfikowanych odpowiednio implementacji algorytmów wyszukiwania najkrótszej ścieżki.
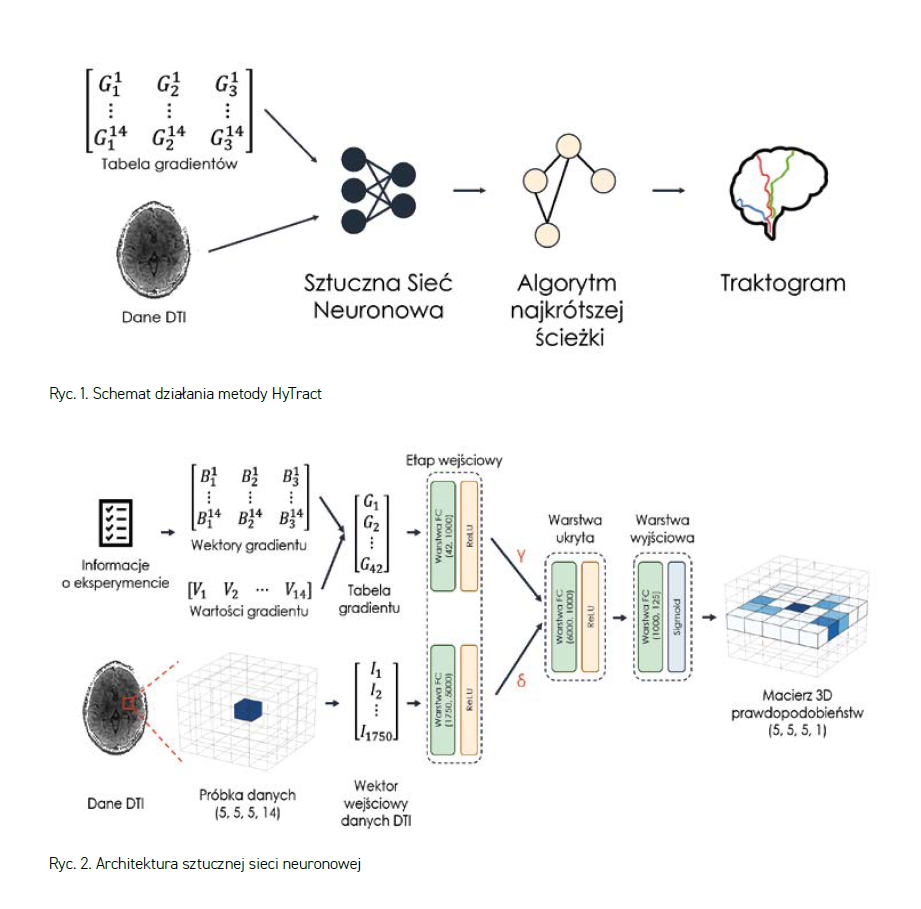
Sieć neuronowa przetwarza dane z wykorzystaniem 4 warstw gęstych (rycina 2). Tabela gradientów oraz sam sygnał DTI przetwarzane są niezależnie przez osobne zestawy wag. Wektory wyjściowe tych warstw są następnie łączone ze sobą i przetwarzane razem przez kolejne dwie warstwy. Wszystkie warstwy poza ostatnią posiadają aktywację ReLU. Wynikiem działania jest trójwymiarowa macierz, w której każda komórka macierzy odpowiada wokselowi z badania wejściowego. Komórka ta reprezentuje prawdopodobieństwo, z jakim w danym wokselu znajduje się to samo włókno nerwowe co w wokselu centralnym. Dane przetwarzane są w małych porcjach (np. 5 x 5 x 5 wokseli), próbkowanych, w taki sposób, aby w wokselu centralnym (pozycja 3, 3, 3) znalazło się rozpatrywane włókno nerwowe, a w przypadku pierwszego kroku punkt startowy określony przez osobę wykonującą analizę.
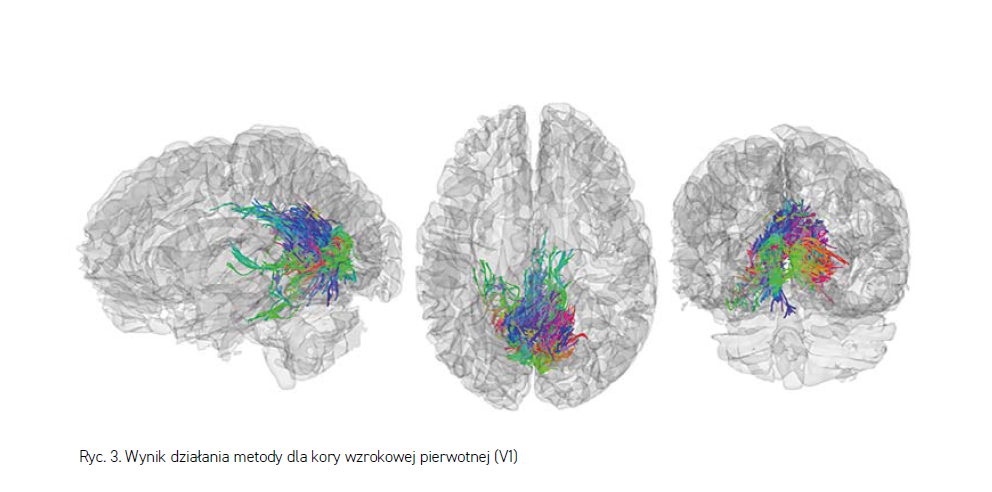
Zastosowanie odpowiednio dostosowanego algorytmu najkrótszej ścieżki (np. Dijkstra, A*) pozwala dynamicznie budować reprezentację włókna nerwowego poprzez próbkowanie kolejnych wycinków badania DTI. Po odwzorowaniu wszystkich możliwych włókien nerwowych prezentowane są one w postaci traktogramu, jak w przykładzie widocznym na rycinie 3. W tak specyficznym zastosowaniu jak planowanie przedoperacyjne pozwala to znacznie przyspieszyć pracę, zważywszy, iż analizę traktograficzną można ograniczyć do regionu zainteresowania – planowanego pola operacyjnego.
W zastosowaniach krytycznych jak medycyna operacyjna jednym z najważniejszych kryteriów wobec nowych technologii jest zaufanie. Nie jest łatwo o zaufanie, gdy proponowane rozwiązanie daje sztywną, suchą odpowiedź typu TAK/NIE. Odpowiedź, której trzeba zaufać „w ciemno”, zaufać w rezultat obliczeń trudnych do wytłumaczenia czy wyjaśnienia. W takich przypadkach istotne jest, aby wynik działania AI nie był absolutem, aby mógł być interpretowalny przez człowieka. Zamiast odpowiedzi w stylu TAK/ NIE można zwracać wynik w procentach, gdzie 100 oznacza zdecydowanie TAK a 0 – zdecydowanie NIE. Inny wydźwięk ma wartość 5, a inny 45, obie są poniżej 50 i oznaczają NIE, ale ta druga jest dużo mniej pewnym wskazaniem.
W przypadku neurochirurgii funkcjonalnej sztuczna inteligencja znajduje zastosowanie w trakcie samych zabiegów operacyjnych. Jednym z aspektów neurochirurgii funkcjonalnej są zabiegi głębokiej stymulacji mózgu (DBS). W trakcie tych zabiegów w mózgu pacjenta umieszczane są elektrody stymulujące. Podobnie jak ma to miejsce w przypadku rozrusznika serca, wszczepiona elektroda dzięki odpowiednio dobranych impulsów elektrycznych stymuluje w miejscu wszczepienia aktywność tkanki mózgowej.
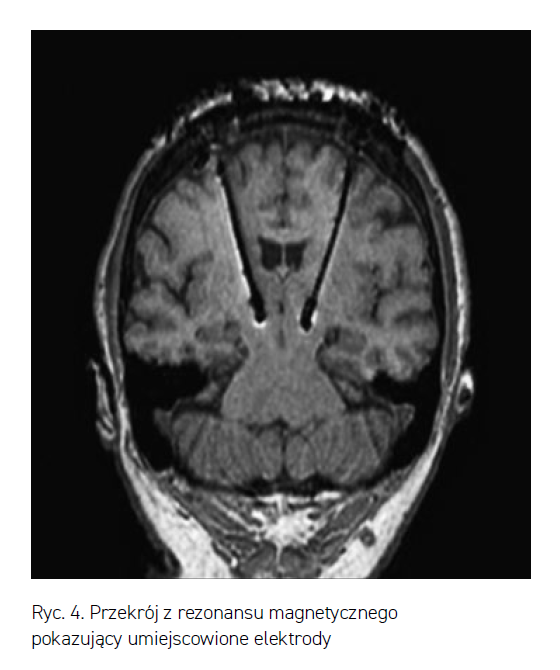
Przykładowe umiejscowienie elektrod w wyniku operacji DBS pokazane jest na rycinie 4.
Zabiegi głębokiej stymulacji mózgu najczęściej wykonuje się w przebiegu leczenia choroby Parkinsona (PD), dystonii, drżenia samoistnego i pewnych chorób afektywnych.
Precyzyjne umiejscowienie elektrody jest krytyczne dla prawidłowego przebiegu zabiegu operacyjnego oraz dla uzyskania maksymalnie korzystnego efektu terapeutycznego. Elektroda musi być umiejscowiona z milimetrową dokładnością, często choćby z dokładnością do ułamka milimetra.
Problemem jest to, iż w przypadku głębokiej stymulacji mózgu – jak sama nazwa wskazuje – cel operacji, miejsce wszczepienia elektrody, znajduje się głęboko wewnątrz mózgu i nie jest bezpośrednio widoczny. Często nie jest również widoczny na wynikach obrazowania medycznego – wynikach z tomografu komputerowego i/lub rezonansu magnetycznego. W takich przypadkach przybliżona lokalizacja określana jest pośrednio na podstawie położenia innych struktur mózgowia. Neurochirurgia to nie jest jednak dziedzina medycyny, w której przybliżona lokalizacja jest wystarczająca. W tak krytycznych zastosowaniach precyzyjną lokalizację uzyskuje się dopiero w trakcie operacji – i to jest miejsce, w którym AI może w bardzo istotny sposób pomóc lekarzom.
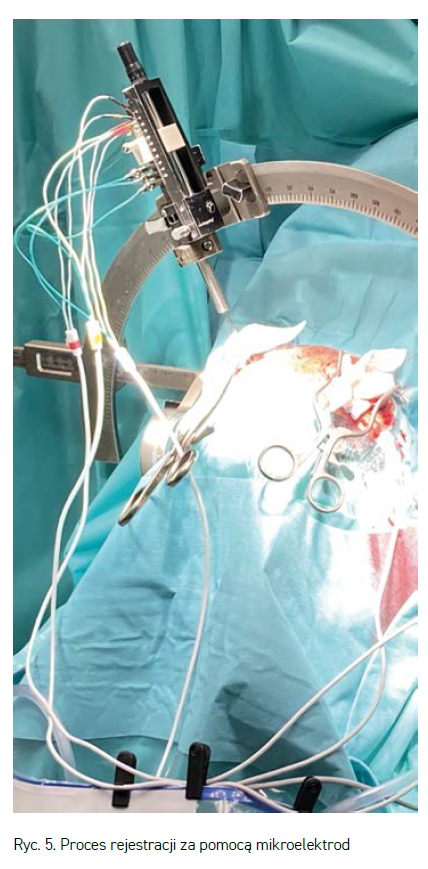
Precyzyjną lokalizację uzyskuje się w trakcie samego zabiegu operacyjnego dzięki mikrorejestracji aktywności elektrycznej tkanki mózgowej. W trakcie zabiegu do mózgu pacjenta wprowadza się kilka (3–5) bardzo cienkich mikroelektrod rejestrujących aktywność elektryczną tkanki nerwowej (rycina 5). Elektrody wprowadzane są w głąb mózgu do poziomu (w przypadku PD) około centymetra powyżej spodziewanego miejsca wstawienia elektrody stymulującej. Następnie elektrody są równolegle opuszczane z krokiem milimetrowym lub mniejszym. Na każdej głębokości zestaw elektrod rejestruje aktywność elektryczną tkanki. Proces krokowego zagłębiania i rejestracji danych trwa dopóki zestaw elektrod nie opuści poszukiwanej struktury. Następnie na podstawie analizy nagrań z elektrod określa się, która z nich na jakich głębokościach i w jakich warunkach fizjologicznych przechodziła przez cel zabiegu operacyjnego.
Za pomocą komputerowej analizy zarejestrowanych sygnałów jesteśmy w stanie z ponad 90-procentową pewnością określić, które z nich zarejestrowane zostały w celu operacji.
Jesteśmy w stanie również określić na podstawie nagrań rodzaj aktywności tkanki nerwowej, a poprzez to nie tylko wskazać, gdzie znajduje się struktura będąca celem operacji, ale również, jaka jej część może być dobrym miejscem do wstawienia w dalszej części operacji stałej elektrody stymulującej.
Sztuczna inteligencja znajduje w analizie sygnałów pozyskanych z mikroelektrod bardzo wiele zastosowań. Poczynając od usuwania szumów i zakłóceń z zarejestrowanych sygnałów poprzez ich analizę w domenach czasu i częstotliwości aż po sam proces klasyfikacji.
Opracowane zostały zarówno rozwiązania używające klasycznych metod uczenia maszynowego, jak również używające głębokich sieci neuronowych. Sieć neuronowa została tak wytrenowana, iż w trakcie klasyfikacji nagrań sama wyszukuje i usuwa zakłócenia obecne w analizowanym sygnale, które mogłyby negatywnie wpłynąć na jakość wskazań.
Sieć klasyfikująca ma ponad 600 milionów parametrów i została opisana w publikacji w prestiżowym czasopiśmie naukowym. Sieć neuronowa analizuje dane pozyskane w trakcie zabiegu operacyjnego w czasie poniżej dwóch minut, co pozwala na użycie opisanych rozwiązań w warunkach sali operacyjnej.
Niezwykle istotne jest to, iż metody analizy nagrań pozyskanych z DBS dają wyniki, które następnie interpretuje lekarz. Nie jest celem, aby sztuczna inteligencja zastąpiła lekarzy – ekspertów w ochronie zdrowia, ale była dla nich pomocą pozwalającą podejmować decyzje szybciej i sprawniej, a poprzez to minimalizować ryzyka dla pacjenta.
Analogicznie wyniki otrzymywane z traktografii są pomocą i materiałem dla lekarzy wspierającym w podejmowaniu decyzji podczas planowania zabiegów operacyjnych.
Link do nagrania: Medycyna i sztuczna inteligencja – wzajemny wpływ na rozwój
https://www.youtube.com/embed/wHJD-ytwMCU&t=15223s
Zobacz także „Medycyna i sztuczna inteligencja – wzajemny wpływ na rozwój”.