Zakażenia wielolekooporne (MDR) stanowią poważne ryzyko dla zdrowia publicznego. W jednym z badań szacuje się, iż oporność bakterii na środki przeciwdrobnoustrojowe była odpowiedzialna za 1,27 miliona zgonów na świecie w 2019 r.
Terapia fagowa (znana również jako terapia bakteriofagowa), która opiera się na zastosowaniu wirusów zabijających bakterie, odniosła sukces jako środek przeciwdrobnoustrojowy w Europie Wschodniej, a w tej chwili znajduje coraz większe zastosowanie w badaniach klinicznych i przypadkach współczucia na całym świecie. Pomimo sukcesu terapii fagowej w leczeniu zakażeń MDR, wciąż kilka jest danych na temat wpływu fagów na ludzkiego gospodarza.
Na czym polega terapia fagowa?
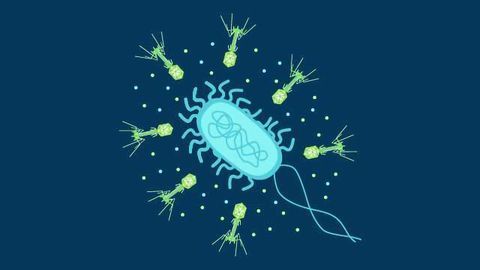
W terapii fagowej bakteriofagi wiążą się z unikalnym receptorem bakteryjnym i wstrzykują swój materiał genetyczny, który koduje wszystkie składniki niezbędne do tworzenia wirusów potomnych. Składniki te łączą się i tworzą nowe wirusy, które są uwalniane w wyniku lizy komórki bakteryjnej. Gdy wszystkie bakterie zostaną poddane lizie, przestaną się namnażać. Podobnie jak inne wirusy, fagi mogą pozostawać w stanie uśpienia do czasu pojawienia się większej liczby bakterii.
Badanie przeprowadzone przez naukowców z Geisel School of Medicine w Dartmouth wykazało, iż komórki nabłonkowe ludzkich dróg oddechowych mogą wykryć fagi lecznicze, wywołując reakcję prozapalną zależną od specyficznych adekwatności fagów i mikrośrodowiska dróg oddechowych.
Ustalenia te, opublikowane w Biologia PLOSsugerują, iż interakcje z ludzkim gospodarzem powinny stać się ważnym czynnikiem przy rozważaniu racjonalnego projektowania terapii fagowych. Ponadto naukowcy sugerują, iż możliwe byłoby wykorzystanie odpowiedzi immunologicznych na fagi w celu poprawy skuteczności terapii fagowej w indywidualnych przypadkach.
Fagi wywołują unikalną odpowiedź immunologiczną
W badaniu badacze chcieli lepiej zrozumieć, w jaki sposób fagi lityczne oddziałują z komórkami nabłonka dróg oddechowych (AEC), czyli tkanką kolonizowaną przez biofilmy bakteryjne w przypadku kilku przewlekłych chorób układu oddechowego.
Co to są biofilmy bakteryjne?
Biofilmy bakteryjne to skupiska bakterii przyczepionych do powierzchni i/lub siebie nawzajem i osadzone w samodzielnie wytworzonej matrycy. Matryca biofilmu składa się z substancji takich jak białka, polisacharydy i eDNA i zapewnia dodatkową ochronę bakteriom. W biofilmie bakterie mogą stosować kilka strategii przetrwania, aby ominąć układ odpornościowy żywiciela.
Korzystanie z panelu Pseudomonas aeruginosa (P. aeruginosa) fagami i ludzkimi AEC od osoby chorej na mukowiscydozę naukowcy ustalili, iż interakcje między fagami i AEC zależą od specyficznych adekwatności fagów, a także cech mikrośrodowiska.
Nabłonek dróg oddechowych również reaguje na ekspozycję na fagi, zmieniając swój profil transkrypcyjny i wydzielając specyficzne dla fagów cytokiny przeciwwirusowe i prozapalne.
„Odkryliśmy, iż różne fagi mają różną zdolność do agregacji i utrzymywania się w środowisku dróg oddechowych, co może mieć wpływ na ich zdolność do wiązania i zakażania specyficznego gospodarza bakteryjnego” – dr Paula Zamora, doktor habilitowany w Geisel School of Medicine w Dartmouth i kierownik – powiedział autor badania Sieci technologiczne.
Kontynuuj czytanie poniżej…
„Odkryliśmy również, iż fagi wywołują różne odpowiedzi immunologiczne. W naszym przypadku niektóre fagi były bardziej prozapalne, podczas gdy inne wyzwalały przeciwwirusową odpowiedź immunologiczną. W zależności od specyficznych warunków mikrośrodowiska, w którym żyją docelowe drobnoustroje, te odpowiedzi immunologiczne można wykorzystać do poprawy efektu terapeutycznego fagów” – dodała.
Potencjalne korzyści terapii fagowej w leczeniu zakażeń MDR
Stosowanie terapii fagowej zostało ograniczone ze względu na konieczność znalezienia faga zabijającego konkretny szczep bakterii. „Wiele instytucji akademickich i medycznych tworzy duże biblioteki fagów, które ułatwią proces selekcji fagów [to overcome this]”- powiedziała dr Jennifer Bomberger, profesor mikrobiologii i immunologii w Geisel School of Medicine w Dartmouth.
Ze względu na swoją specyficzność fagom brakuje niektórych problemów charakterystycznych dla zwykłych środków przeciwdrobnoustrojowych w zakresie zabijania bakterii o szerokim spektrum działania. W połączeniu z ich zdolnością do samoamplifikacji, uważa się, iż powtarzane terapie fagami nie są tak konieczne jak zwykłe antybiotyki. Jednakże potrzebne są dalsze badania w celu określenia skutecznego dawkowania terapii fagowych.
„Wiele naturalnie występujących adekwatności fagów można wykorzystać do poprawy ich skuteczności terapeutycznej. Na przykład niektóre fagi kodują depolimerazy i lizyny, które mogą degradować matryce biofilmu, co może pomóc w penetracji fagów i wiązaniu się z ich bakteryjnym gospodarzem” – wyjaśnia Bomberger.
Chcesz więcej najświeższych wiadomości?
Subskrybuj Sieci technologicznecodzienny biuletyn, dostarczający codziennie najświeższe informacje naukowe bezpośrednio do Twojej skrzynki odbiorczej.
Subskrybuj ZA DARMO
Zrozumienie wpływu fagów na organizm ludzki
Ponieważ replikacja fagów zależy od receptora bakteryjnego, od dawna panuje przekonanie, iż fagi powinny być nieszkodliwe dla komórek ssaków.
„Mimo iż fagi nie mogą replikować się w komórkach ssaków, fagi mogą wykazywać wzorce molekularne związane z patogenami, które mogą być rozpoznawane przez receptory rozpoznające wzorce immunologiczne na komórkach ludzkich. Fagi są uwalniane z komórek bakteryjnych poprzez ich lizę, co jest kluczem do ich działania przeciwdrobnoustrojowego. Mechanizm ten oznacza, iż składniki bakteryjne zostaną również uwolnione do środowiska zewnątrzkomórkowego, co może wzmocnić odpowiedź immunologiczną” – powiedział Bomberger.
„Nasze badanie, a także kilka innych, w których oceniano wpływ terapii fagowej na człowieka, zgadzają się, iż odpowiedzi immunologiczne wydają się samoograniczające i nie powodują wyniszczających skutków u osób, które otrzymały ten lek”.
Pomimo rosnącego zainteresowania klinicznego, dane na temat wpływu fagów na człowieka są ograniczone. Bomberger zwrócił uwagę na koszty czasowe i finansowe związane z przygotowaniem fagów pozbawionych endotoksyn i braku in vitro modele jako przyczyny braku danych: „W tym względzie mieliśmy przewagę wynikającą z kilkuletniego doświadczenia w pracy z modelami hodowli komórkowych, które replikują powierzchnię błony śluzowej dróg oddechowych, co ułatwiło nam przeprowadzenie tych badań”.
Implikacje dotyczące spersonalizowanego leczenia infekcji MDR
Obecnie FDA zaleca zapewnienie zawartości fagów, endotoksyn, sterylności i aktywności litycznej przeciwko szczepom bakteryjnym pacjenta w ramach racjonalnego projektu terapii fagowej. Jednak w ramach projektowania terapii fagowej nie jest wymagana ocena wpływu fagów na komórki ludzkie. „Mamy nadzieję, iż nasze odkrycia mogą dodać interakcje z ludzkim żywicielem jako jeden z czynników, które należy wziąć pod uwagę” – powiedział Zamora.
Na podstawie swoich ustaleń naukowcy proponują, iż odpowiedź immunologiczną na fagi można wykorzystać do poprawy skuteczności terapii fagowej w każdym indywidualnym przypadku. Ocena odpowiedzi immunologicznych może również pomóc w selekcji fagów w obliczu fagów o podobnej specyficzności bakteryjnej. Wykazano również, iż niektóre fagi powodują wytwarzanie przeciwciał neutralizujących, które mogą zmniejszać skuteczność terapii fagowej.
Zamora podsumowuje: „Mamy nadzieję, iż nasze odkrycia doprowadzą do dalszych badań oceniających wpływ fagów na ludzkiego żywiciela. Aby było to możliwe, musimy opracować lepsze testy, które podsumowują aktywność fagów, być może poprzez uwzględnienie różnych typów komórek, biofilmów wielodrobnoustrojowych, śluzu i innych czynników imitujących środowisko błony śluzowej dróg oddechowych osób z przewlekłą chorobą płuc”.
Dr Paula Zamora i dr Jennifer Bomberger rozmawiały z Blakiem Formanem, starszym autorem artykułów naukowych i redaktorem Technology Networks.
O rozmówcach:
Dr Paula Zamora jest adiunktem podoktorskim w Geisel School of Medicine w Dartmouth. Stopień doktora uzyskała na Uniwersytecie Vanderbilt. Jej obecne badania skupiają się na odpowiedziach komórkowych na fagi lecznicze i inne uszkodzenia w płucach osób chorych na mukowiscydozę.
Doktor Jennifer Bomberger jest profesorem mikrobiologii i immunologii w Geisel School of Medicine w Dartmouth. Uzyskała tytuł doktora fizjologii komórkowej na Uniwersytecie Stanowym Michigan. Jej zespół badawczy bada interakcje wirusowo-bakteryjne i wielodrobnoustrojowe w drogach oddechowych.
Odniesienie: Zamora PF, Reidy TG, Armbruster CR i in. Bakteriofagi lityczne indukują wydzielanie cytokin przeciwwirusowych i prozapalnych z ludzkich komórek nabłonka dróg oddechowych. PLoS Biol. 2024;22(4):e3002566. doi: 10.1371/journal.pbio.3002566